Сульфатами називають солі кислоти сірчаної H2SO4. Багато з цих сполук, і це більшість з них, розчинні у воді, мають невелику твердість і світле забарвлення. Велика частина сульфатів осадового походження, це озерні і хімічні морські опади. Вони є мінералами. В їх кристалічній структурі міститися комплексні аніони SO42- (рис.1). Найбільш поширеними сполуками є сульфати двовалентних підстав. Це сильні підстави, які є важкорозчинні (Ва2 +, Sr2 + і Ca2 +). Підстави, які слабші, утворюють часто нестійкі основні солі. До них можна віднести сульфати окисленого заліза. До підстав сильнішим - подвійні солі і кристалогідрати.
Сульфати є одними з важливих аніонів. Вони знаходяться у всіх поверхневих водах. І головним джерелом їх є хімічні процеси розчинення і вивітрювання мінералів, що містять сірку, і процеси окислення сірки і сульфідів.
У великій кількості сульфати надходять у водойми в результаті відмирання організмів, окислення водних і наземних речовин тваринного і рослинного походження, з підземними стоками
У великій кількості сульфатні іони містяться в промислових стоках, в стічних водах комунального господарства і від виробництв сільського господарства.
Для мінералізованих вод характерна іонна форма SO42-. Але сульфати здатні утворювати стійкі нейтральні пари, (наприклад CaSO4, MgSO4), коли збільшується мінералізація. Ці сполуки відіграють важливу роль в непростому круговороті сірки в природі. Під дією сульфатредуцирующих бактерій і при відсутності кисню вони відновлюються до сульфідів і сірководню. Але як тільки в природній воді з'являється кисень, знову окислюються до сульфатів.
Зелені рослини і деякі бактерії (автотрофи) для побудови свого білкового речовини отримують сульфати розчинні у воді. Після їх відмирання інші бактерії (гетеротрофи) виводять з них протеїнову сірку у вигляді сірководню. Останній, в присутності кисню, окислюється до сульфатів.
У природній воді концентрація цих сполук знаходиться в широких межах. У дощових водах кількість сульфатів міститься в межах від 1 до 10 мг / дм3. У водах прісних озер і річках ці значення будуть від 5-10 до 60 мг / дм3. А якщо взяти підземні води, то цей показник часто набагато вище.
У поверхневих водах кількість сульфатів знаходиться в залежності від пори року. Також на цей показник велику роль надає діяльність людини пов'язана з господарством, біологічний стан водного об'єкта, різні окисні і відновні процеси.
Великий вміст сульфатів негативно впливає на якість води, органолептичні показники води погіршуються. На смак така вода солонувата. Також підвищений вміст цього показника в воді впливає на фізіологічні процеси в організмі людини. Іони сульфатів погано всмоктуються з кишечника, і при підвищеній концентрації діють як проносне, це призводить до розладу шлунково-кишкового тракту, порушується процес травлення. Така вода також завдає шкоди волоссю, викликає подразнення слизової шкіри і очей. Тому цей показник строго регламентується і введений під контроль. Нормативний зміст сульфатів води питної не повинно перевищувати 500мг / дм3.
Також воду з великим показником сульфатів не рекомендують використовувати в господарстві і побуті. За дією кальцію вони утворюють накип.
Чи не доведений вплив сульфат-іонів у питній воді на процеси корозії, але якщо при концентрації більше 200 мг / дм3 використовують свинцеві труби, то може статися вимивання свинцю в воду.
В аналітичної лабораторії на виробництві ТОВ «КоролевФарм» , Яке працює за контрактом, а саме на ділянці ФХІ (фізико-хімічних випробувань) , При визначенні хімічних і органолептичних показників води визначення сульфатів є обов'язковим. Випробування проводять за ГОСТом 31940-12 методом титрування з використанням трилону Б (діапазон вимірювань від 25 до 500мг / дм3). лабораторія ФХІ оснащена всім необхідним обладнанням і засобами вимірювань, а також реактивами, матеріалами, посудом.
Співробітники лабораторії перед проведенням вимірювання готують необхідні розчини:
- розчин барію хлористого, (молярна концентрація 0,025 моль / дм3);
- розчин іонів магнію (молярна концентрація 0,025 моль / дм3);
- розчин буферний аміачний (рН (10 ± 0,1));
- розчин аміаку (молярна концентрація 10 ммоль / дм3);
- індикатор еріохрома чорного Т;
- розчин трилону Б (молярна концентрація 0,025 моль / дм3);
- 2% -ний розчин азотнокислого срібла.
Далі лаборант визначає коефіцієнт поправки, щоб концентрація розчину динатрієвої солі ЕДТУ, була наближена до 25 ммоль / дм3.
Для цього беремо колбу конічну (обсяг 250 см3), вносимо в неї (піпеткою) 10 см3 розчину іонів Mg. Потім додаємо 90 см3 води дистильованої, 5 см3 розчину аміачного буферного, 5-7 крапель розчину індикаторного (або суміші індикаторної 0,1 г і проводимо титрування розчином динатрієвої солі ЕДТУ, використовуючи титратор або бюретки (рис. 2). Титруючи до того моменту, поки колір розчину чітко зміниться з червоно-фіолетового на синій із зеленуватим відтінком. Фіксуємо кількість розчину динатрієвої солі ЕДТУ, який ми витратили на титрування Vтр. Далі проводимо ще 2 титрування, при цьому перше значення враховується як контрольне визначення. до ффіціент поправки До розраховують за формулою:
К = 10 / Vтр, де
10 - кількість розчину іонів Mg в см3, а Vтр.- кількість Na 2 ЕДТУ, витраченого на випробування.
(К) розраховуємо за формулою для кожного з 3 проведених титрування. А за остаточний результат беремо середнє значення і воно повинно бути в межах 1,00 ± 0,03.
Також необхідно визначити (К) для приведення концентрації MgSO4ілі MgCl2 до 0,25 моль / дм3.
Для цього знову беремо колбу конічну (об'ємом 250 см3), вносимо піпеткою трилону Б (динатрієва сіль ЕДТУ) (10 см3), потім 90 мл води дистильованої, 5 мл аміачного буфера, 5-7 крапель індикаторного розчину (або суміші індикаторної 0,1 г) і проводимо титрування розчином MgSO4 (MgCl2). Титрування проводимо до моменту зміни синього забарвлення розчину до лілового. Фіксуємо кількість магнію хлористого (сірчанокислого), яке ми витратили на титрування VMg. Коефіцієнт (К1) поправки розраховуємо за формулою:
К1 = 10 / VMg,
де 10 - кількість розчину динатрієвої солі ЕДТУ в см3, VMg - кількість розчину MgSO4ілі MgCl2, витраченого на випробування. (К) розраховуємо за формулою також для кожного з 3 проведених титрування і за кінцевий результат беремо середнє значення (1,00 ± 0,03),
Перед проведенням випробування при необхідності видаляємо з проби зважені і колоїдні речовини, які можуть вплинути на кінцевий результат. Для цього пробу води (250 мл) фільтруємо через фільтр, пори якого мають розмір 0,45 мкм.
Підготовка проби до титрування
Одночасно аналізуємо не менш 2-х проб води в паралелі (обсяг кожної 100 см3).
Беремо дві конічної колби об'ємом 250 см3 і вносимо в кожну з них піпеткою по 100 мл нашої проби. Потім капає три краплі (в кожну колбу) соляної кислоти концентрованої, 25 мл розчину барію хлористого, ставимо на водяну баню (рис. 3), нагріваємо і кип'ятимо 10 хв. Далі баню вимикаємо і витримуємо 1 годину. Потім проби охолоджуємо на повітрі до температури 200 ° С (± 30С).
Далі вміст наших колб фільтруємо через фільтр (рис. 4). Фільтр перед фільтрацією промиваємо гарячою водою. Фільтруємо так, щоб осад сірчанокислого барію не потрапив на фільтр. Осад в колбі промиваємо 5-6 разів водою гарячої і цю ж воду теж пропускаємо через фільтр. Потім промиваємо фільтр водою дистильованою кілька разів до отсутствіяіонов хлориду, наявність або відсутність яких можна визначити так: до 5 мл води, яку використовували для промивання, капаємо 3-5 краплі розчину АgNO3 і розмішуємо. Помутніння розчину є ознакою наявності хлорид-іонів.

Мал. 4 Фільтрація випробуваної
проби через фільтр
Далі поміщаємо фільтр в колбу, де проводили осадження. Додаємо 5 мл аміаку, акуратно скляною паличкою розгортаємо фільтр і розправляємо його по дну. Потім додаємо на 5 мг сульфат-іонів (передбачуваного змісту в нашій пробі води) по 6 мл розчину динатрієвої солі ЕДТУ. Потім колбу обережно нагріваємо на плитці і кип'ятимо до розчинення осаду, який потрапив з фільтром, не більше 3-5 хв. При цьому періодично помішувати.
проведення титрування
До остигнула пробі доливаємо 50 мл води дистильованої, потім 5 мл аміачного буферного розчину, потім 5 крапель індикаторного розчину спиртового (або 0,1 г суміші індикаторної сухий). Далі титруємо (рис. 5) надлишок динатриевой солі ЕДТУ розчином MgSO4ілі MgCl2 до моменту переходу синього кольору до фіолетового.
Якщо наперед відомо, що в випробуваної пробі зміст сульфат-іонів> 250 мг / дм3, то пробу беремо об'ємом 50 мл або того менше і доводимо дистильованою водою в колбі для осадження до 100 мл.
Якщо наперед відомо, що сульфат-іонів <50 мг / дм3, то обсяг проби беремо 200 мл, додаємо 3-4 краплі HClконцентрірованной (до рН≤2 по індикаторним папером). Потім випаровуємо прямо в колбі до обсягу 100 мл.
Далі обробляємо пробу, як описано вище (Підготовка проби до титрування).
Обробка результатів
Масову концентрацію сульфатів (Х, мг / дм3) в випробуваної пробі води розраховуємо за формулою:
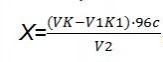 , де
, де
V - об'єм розчину динатрієвої солі ЕДТУ, який використовували при підготовці проби до титрування;
К - коефіцієнт поправки для приведення концентрації розчину Na 2 ЕДТУ до 0,025 моль / дм3;
V1 - об'єм розчину MgSO4ілі MgCl2, використаного для титрування;
К1 - коефіцієнт поправки для приведення концентрації розчину MgSO4ілі MgCl2 до 0,025 моль / дм3;
96 - маса сульфат-іонів (молярна);
с - концентрація розчину Na 2 ЕДТУ, молярна (дорівнює 0,025 моль / дм3);
V2 - кількість проби води, взятої для вимірювання.
Отримані результати співробітник хімічної лабораторії (ФХІ) фіксує в робочому журналі. Оформлює протокол з даними і передає в відділ контролю якості .

